/reboot/media/ebeb4c52-755c-11e8-bf84-fa163e14ea56/7d2448a0-cab2-11ec-8977-0242ac140006/1-1-research-gd7885fbd9-1920.jpg)
La Lumière Pulsée pour la réduction bactérienne : Impact des paramètres physiques sur Aspergillus brasiliensis
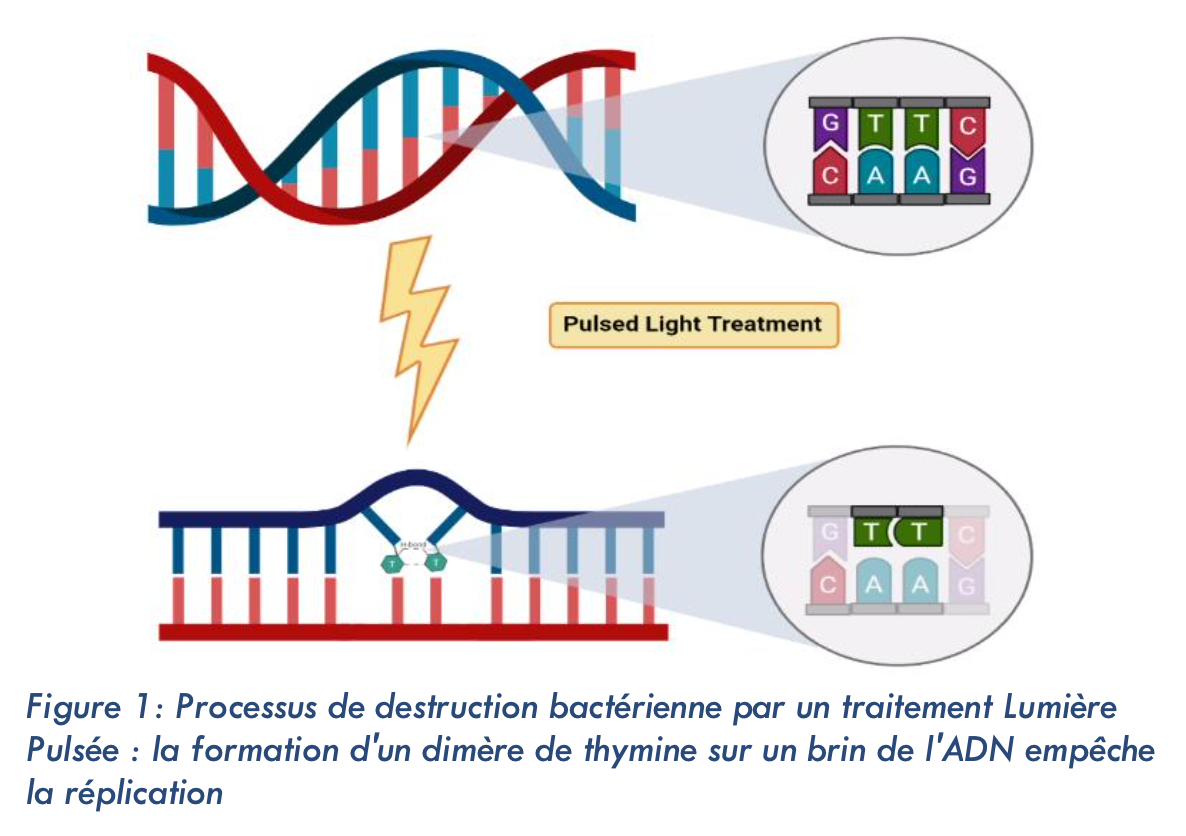
Les maladies d’origine alimentaire liées à l’ingestion de microorganismes pathogènes sont la cause de morbidité de 600 millions de personnes et de 420 000 morts chaque année. Pour garantir une sécurité alimentaire, plusieurs procédés ont permis de réduire la charge microbienne des aliments : traitements thermiques, chimiques et athermiques. Parmi ces derniers, l’utilisation des UV à base de mercure pour une action bactéricide a été démontrée par Bedford (1927) et Gates (1929). C’est en 1980, au Japon, que la technologie lumière pulsée a vu le jour et a permis de mettre en évidence l’action germicide de flashs intenses de lumière sur les microorganismes. Cette alternative aux lampes UV mercure utilise un gaz xénon, inerte chimiquement, plus écologique mais aussi plus performant. L’activité bactéricide du large spectre lumineux (200‑1300 nm) repose sur son absorption par le double‑brin d’ADN, ce qui provoque une rupture de ce dernier et la formation de dimères de thymine rendant la réplication bactérienne impossible. La lumière pulsée a prouvé son efficacité notamment sur des micro‑organismes de référence pour la décontamination par les UV, comme la moisissure Aspergillus brasiliensis DSM 1988, et d’autres micro‑organismes fréquemment retrouvés dans l’industrie agro‑alimentaire. Alors que de nombreux articles scientifiques ont fait état de l’efficacité de la lumière pulsée, peu ont mis en évidence l’impact des paramètres physiques de la lumière sur l’activité microbiologique. Cette étude se propose de faire le parallèle entre deux sciences, celle du vivant et celle de la physique.
Méthodes
Deux dispositifs de lumière pulsée ont été utilisés dans cette étude :
-
Un dispositif lumière pulsée au xénon dont la lampe a été brevetée par la société Sterixene. Les fréquences d’utilisation vont de 0,1 à 7Hz maximum. Ce dispositif permet l’émission de flashs à une tension de 1500 à 2800 V pour une longueur de plasma de 150 mm.
-
Un dispositif lumière pulsée au xénon haute fréquence, pour une tension de 1000V, la fréquence est de 50 Hz. Pour 400V, la fréquence maximale applicable est de 350 Hz. La longueur du plasma est de quelques millimètres.
Les paramètres physiques impactant directement l’efficacité de décontamination étudiés ici sont : la distance de la matrice par rapport à la source optique, la tension appliquée, le nombre de flashs ou durée de traitement, la fréquence et la concentration de l’inoculum.
Les essais ont été conduits sur des Bio‑indicateurs UV en PA66, qui se composent d’un coupon de dimension 15x20 mm sur lequel 100 μL d’une suspension bactérienne est déposée en une goutte (concept breveté). Le coupon est ensuite séché sous PSM pendant plusieurs heures. Le dénombrement des Bio‑indicateurs est réalisé par récupération de l’inoculum avec un écouvillon, puis des dilutions successives en Tryptone- Sel. L’efficacité de décontamination est déterminée avec le log de réduction de l’échantillon traité (en triplicat) par rapport à un échantillon témoin non‑traité. Tous les essais ont été réalisés sur un inoculum sec d’Aspergillus brasiliensis, moisissure de référence pour la décontamination par les UV.
Résultats
- Impact de la distance : l’efficacité de décontamination d’un traitement lumineux est directement liée à la fluence en J/cm2 reçue par l’inoculum Cette valeur a été mesurée avec un fluencemètre Gentec UP17P‑6S‑H5‑D0 . A 2800V, la fluence reçue à 10 mm de distance est de 2,345 J/cm2. A 20 mm de distance, la fluence est équivalente à 2,023 J/cm2. Quand l’échantillon est placé 100 mm de la source, la fluence décroît à 0,212 J/cm2. En association avec la fluence reçue, la décontamination d’un inoculum d’Aspergillus brasiliensis est observée à hauteur de 4,7 log pour un seul flash à 2800V, à une distance de 10mm. La réduction logarithmique est de 1,7 log, dans les mêmes conditions, quand le Bio‑indicateur est placé à plus de 100 mm de la source.
- Impact du nombre de flashs : Pour une fluence totale fixe de 12,55 J/cm2 reçue par l’échantillon (fluence maximale applicable mentionnée par la FDA), des traitements de 9 flashs à 1,4 J/cm2 et de 5 flashs à 2,5 J/cm2 ont été appliqués aux échantillons. La réduction bactérienne obtenue pour 5 flashs à 2,5 J/cm2 est de 6,4 log, contre 3,6 log avec 9 flashs à 1,4 J/cm2, soit 2,8 log de moins
- Impact de la fréquence : pour ces essais, deux dispositifs ont été étudiés. Le premier est le dispositif initial haute tension avec des fréquences limitées. Il a été constaté qu’un traitement de 3 flashs ultra intense à des fréquences allant de 0,5 à 4Hz entraînait une réduction des niveaux de décontamination de 1,9 log à 1,4 log. Pour aller plus loin, le dispositif haute fréquence a été utilisé. Les voltages maximaux sont moins élevés que pour le dispositif lampe 150mm, mais il permet l’application de fréquence jusqu’à 350 Hz. Pour un couple voltage/fréquence donné, les essais visent à déterminer quel paramètre est privilégié pour une bonne efficacité de décontamination. Les deux voltages extrêmes ont été testés : 400V (minimum) et 1000 V (maximum). Les fréquences maximales applicables sont respectivement de 350Hz et 50Hz. Pour un couple 400V/350Hz, à 20 mm de distance et pour 10 secondes de traitement, le potentiel de réduction s’élève à 2,4 log. Pour un couple 1000V/50Hz, aux mêmes paramètres de tests, la réduction bactérienne est de 1,7 log, soit 0,7 log de différence.
- Impact de la concentration : Pour des paramètres de traitement fixes (1,018 J/cm2), des Bio‑indicateurs à 3, 4, 5 et 6 log d’une suspension d’Aspergillus brasiliensis ont été traités. A une concentration initiale de 3, 4 et 5 log, la totalité soit 100% de l’inoculum a été décontaminé. Cependant, à une concentration initiale de 6 log, 4,1 log soit 66% de l’inoculum a pu être décontaminé.
Discussion
Les paramètres de traitement appliqués à un échantillon biologique permettent de conditionner l’efficacité de décontamination. La distance, le nombre de flashs, la puissance des flashs permettent la libération d’une fluence en J/cm2 directement reçue par l’inoculum. Plus ce dernier est proche de la source lumineuse, moins celle‑ci est diffuse et plus elle sera efficace rapidement. La fluence est néanmoins à corréler avec le nombre de flashs puisqu’il a été démontré qu’elle n’était pas additive. En effet, l’étude de la fréquence a montré qu’un flash de puissance élevée sera plus germicide que deux flashs moitié moins intenses, mais dont la fluence totale émise par l’échantillon est égale. Cela démontre un double impact germicide de la technologie lumière pulsée lié à la dose UV mais également à l’élévation de la température et de la pression du microorganisme, observables aux tensions maximales. Le pic d’intensité et la durée du flash, deux facteurs associés aux paramètres physiques de la lampe et de l’électronique, sont directement corrélés à la décontamination. Si cela n’est pas discuté ici, il a également déjà été démontré qu’une électronique ultrapuissante mais mal dimensionnée (durée de flash trop importante et pic d’intensité trop peu intense) ne permettait pas de décontaminer efficacement. C’est un point d’étude supplémentaire sur l’impact des paramètres physiques sur l’efficace microbienne en cours actuellement. En comparaison aux solutions UV classiques à base de mercure qui ont un éclairement continu, la technologie lumière pulsée est basée sur l’application d’impulsions peuvant avoir des fréquences plus ou moins élevées selon les composants électroniques choisis. L’étude de l’application d’une fréquence très élevée permet, quant à elle, de mettre en évidence un impact positif de la valeur de fréquence (350Hz) plutôt que la valeur de tension élevée (1000V). L’application rapide d’un très grand nombre de flashs, comme 350 flashs en 1 seconde, aurait donc une efficacité équivalente en termes de log de réduction bactérienne qu’une puissance de flash élevée, comme observé avec le premier dispositif de lampe xénon à 2800V.
Si les paramètres physiques ont un impact direct sur les niveaux de décontamination, la densité de germes par unité de surface est, elle aussi, un facteur d’étude significatif sur l’efficacité de réduction bactérienne. Pour une surface et une goutte d’inoculation identiques, mais des concentrations de plus en plus importantes soit 3, 4 et 5 log, le traitement Lumière Pulsée permet l’abattement de la totalité de la suspension bactérienne traitée. Cependant, pour des paramètres de traitement similaires, mais une concentration de l’inoculum à 6 log, seuls 66% ont été décontaminés. Cela peut être expliqué par la formation de multi‑couches de micro‑organismes, du fait de la forte densité bactérienne. La lumière pulsée est un traitement de surface, ce qui implique que les sous‑couches de micro‑organismes protégées de la lumière ne peuvent pas être atteintes par le rayonnement lumineux, rendant la destruction difficile voire impossible. L’efficacité d’un traitement lumineux est donc plus difficilement satisfaisante sur des inocula très concentrés et agrégés.
Conclusion
La lumière pulsée a été validée en 1996 par la FDA. En France, elle a été validée et appliquée sur les produits de panification en 2008. Pour chaque aliment, les autorités européennes demandent la preuve de l’absence d’impact négatif sur le produit décontaminé (produits néoformés, migration). La lumière pulsée est une technologie déjà connue et reconnue pour maîtriser les niveaux de contamination sur des matrices alimentaires mais aussi sur du packaging. La difficulté de l’application de cette technologie réside dans le fait que le micro‑organisme visé doit être directement exposé au rayonnement lumineux. Cependant, elle permet d’atteindre des niveaux d’abattement satisfaisants sur tous les micro‑organismes : pathogènes, moisissures, levures, formes sporulées.
C’est une vraie alternative plus écologique et plus efficace à l’utilisation des lampes UV au mercure, nocives pour l’environnement. Il est nécessaire de maîtriser tous les paramètres physiques applicables au dispositif de traitement afin de déterminer les conditions optimales pour une destruction microbienne efficace tout en prenant en compte le contexte industriel.
De nombreuses applications de cette technologie sur des matrices variées ont été évoquées dans la littérature sans tenir compte des vitesses de production, rendant parfois la solution efficace mais inapplicable. Ces enjeux industriels imposent souvent un nombre de flashs très limité, une fréquence élevée et une intensité importante d’où l’importance de comprendre l’impact des paramètres physiques sur la décontamination. La technologie lumière pulsée est largement utilisée pour la décontamination du packaging et évolue timidement vers la décontamination des aliments malgré une technologie athermique, écologique et efficace sur tous les microorganismes.
L’étude approfondie de l’impact de la lumière pulsée à l’échelle du micro- organisme pourrait apporter des informations nécessaires à la compréhension des phénomènes létaux, et permettre d’adapter la technologie à la problématique rencontrée, notamment sur les aliments.
Il existe également d’autres technologies optiques prometteuses et écologiques, comme les LED‑UV, qui utilisent la lumière comme source de décontamination.
Publications récentes
- Elmnasser N. (2007): Pulsed‑light system as a novel food decontamination technology: a review
- Fang (2020): Progress of pulsed light sterilization technology in the food field
- Chen (2015): Pulsed light sterilization of packaging materials
- Slieman, Nicholson (2000): Artificial and solar UV radiation induces strand breaks and cyclobutene pyrimidine dimers in Bacillus subtilis spore DNA
- Gomez‑Lopez (2005): Factors affecting the inactivation of micro- organisms by intense light pulses

Après un DUT Génie Biologique option Industries alimentaires, une licence de Biotechnologies et un Master en Microbiologie appliquée à L’agroalimentaire, au Biomédical et à l’Environnement, Clara Chamontin a rejoint l’équipe Sterixene pour s’intéresser à la problématique de la maîtrise de la Microbiologie pour la sécurité dans le domaine de l’agroalimentaire, du médical et de la cosmétique. En tant que Chef de Projet Microbiologie, et à travers la prise en main de projets de Recherche et Développement, elle s’intéresse aux mécanismes impliqués dans la décontamination par les technologies de Lumière Pulsée et de LED‑UV, et à l’utilisation des traitements lumineux pour la destruction bactérienne.
Email : c.chamontin@sterixene.com
:strip_exif()/reboot/media/ebeb4c52-755c-11e8-bf84-fa163e14ea56/ebebceca-755c-11e8-955b-fa163e14ea56/2-2-logo-sterixene-pulsed-light-uv-led-decontamination-par-lumiere-pulsee-desinfection-sterilisation.png)
:strip_exif()/reboot/media/ebeb4c52-755c-11e8-bf84-fa163e14ea56/ebebceca-755c-11e8-955b-fa163e14ea56/2-2-logo-sterixene-pulsed-light-uv-led-decontamination-par-lumiere-pulsee-desinfection-sterilisation.png)
:recolor():strip_exif()/reboot/media/ebeb4c52-755c-11e8-bf84-fa163e14ea56/95b65cf0-1056-11ea-854f-0242ac130006/0-0-machine-lumiere-pulsee.jpg)
:recolor():strip_exif()/reboot/media/ebeb4c52-755c-11e8-bf84-fa163e14ea56/98b6f0f0-3d28-11ea-8520-0242ac130005/0-0-interieur-machine-3.jpg)
:recolor():strip_exif()/reboot/media/ebeb4c52-755c-11e8-bf84-fa163e14ea56/6c42fb90-1802-11ea-ab0d-0242ac130003/0-0-bioindicateur.jpg)